Интересное:
Изомеры Гексана, свойства, химические реакции
Изомеры Гексана - это соединения с разными физическими свойствами, которые имеют точно такой же элементный состав и молекулярную массу. Термин "изомер", введенный Берцелиусом в 1830 году, происходит от греческого языка, что означает «равные части».
В первой половине XIX века органическая химия находилась в примитивном состоянии. Структуры соединений были неизвестны, и были люди того времени, которые считали, что ничего нельзя узнать о структуре - если она действительно существует. Химики того времени развивали навыки определения состава соединений с помощью анализа горения и гравиметрических методов. В последствии обнаружилось, что два разных алкана содержат разное процентное содержание углерода и водорода, физические свойства этих веществ - точка плавления, точка кипения, показатель преломления и т. д. - будут разными. Они действительно были другими!
Национальный институт безопасности и гигиены труда США (NIOSH) установил рекомендуемый предел воздействия (REL) для изомеров гексана (не н-гексан) на уровне 100 частей на миллион (350 мг / м 3 (0,15 г / куб футов)) в течение 8 -часовой рабочий день. Однако для н-гексана текущий REL NIOSH составляет 50 частей на миллион (180 мг / м 3 (0,079 г / куб фут)) в течение 8-часового рабочего дня.
Гексан, C6H14 - алканы класса органических веществ. В природе встречается в природном газе, добываемом с газовых и газоконденсатных месторождений, в нефти и газе, в нефти.
Формула гексана и изомеры Гексана, особенности
Гексан - это органическое вещество класса алканов, состоящее из шести атомов углерода и четырнадцати атомов водорода.
Химическая формула гексана C6H14. Изомеры Гексана насчитывают пять видов: н-гексан, 2-метилпентан (изогексан), 3-метилпентан, 2,3-они (диизопропил) и 2,2-они (неогексан). Изомеры гексана различаются по своим физическим свойствам.
Формула н-гексан CH3CH2CH2CH2CH2CH3, 2-метилпентан (изогексана) CH3CH (CH3) CH2CH2CH3, 3-метилпентан CH3CH2CH (CH3) CH2CH3, 2,3 они (диизопропил) CH3CH (CH3) CH (CH3) CH3 и 2.2 они (neohexane) СН3) 2СН2СН3.
Названия 5и различных структурных изомеров гексана
Сколько изомеров гексана? - Пять изомеров гексана.
5 Isomers of Hexane - C6H14. James Richard Fromm. Hexane; 2-Methylpentane; 3-MethylPentane; 2,2-Dimethylbutane; 2,3-Dimethylbutane.
Все пять структурных изомеров гексана имеют одинаковую молекулярную формулу C6H14 и одинаковую молекулярную массу 86. Однако каждый из гексанов имеет уникальную температуру кипения.
Физические свойства
| Изомер | M.P. (°C) | B.P. (°C) |
| n-hexane | −95.3 | 68.7 |
| 3-methylpentane | −118.0 | 63.3 |
| 2-methylpentane (isohexane) | −153.7 | 60.3 |
| 2,3-dimethylbutane | −128.6 | 58.0 |
Изомеры гексана • Гексан, CH3CH2CH2CH2CH2CH3, прямая цепь из шести атомов углерода, 2-метилпентан (изогексан), CH3CH (CH3) CH2.
Строение молекулы н-гексана:

Строение молекулы 2-метилпентана (изогексана):
 Строение молекулы 3-метилпентана:
Строение молекулы 3-метилпентана: Строение молекулы 2,3 они (диизопропил):
Строение молекулы 2,3 они (диизопропил):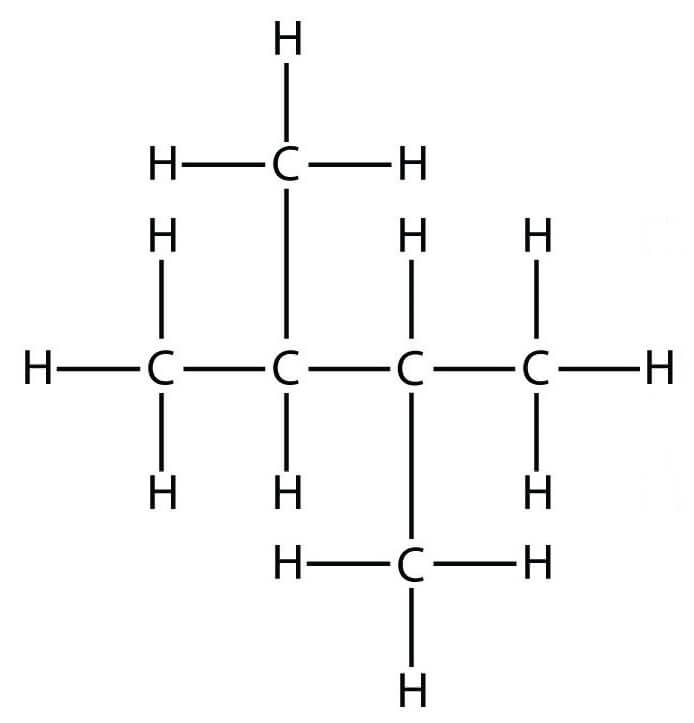 Строение молекулы 2,2 они (неогексана):
Строение молекулы 2,2 они (неогексана):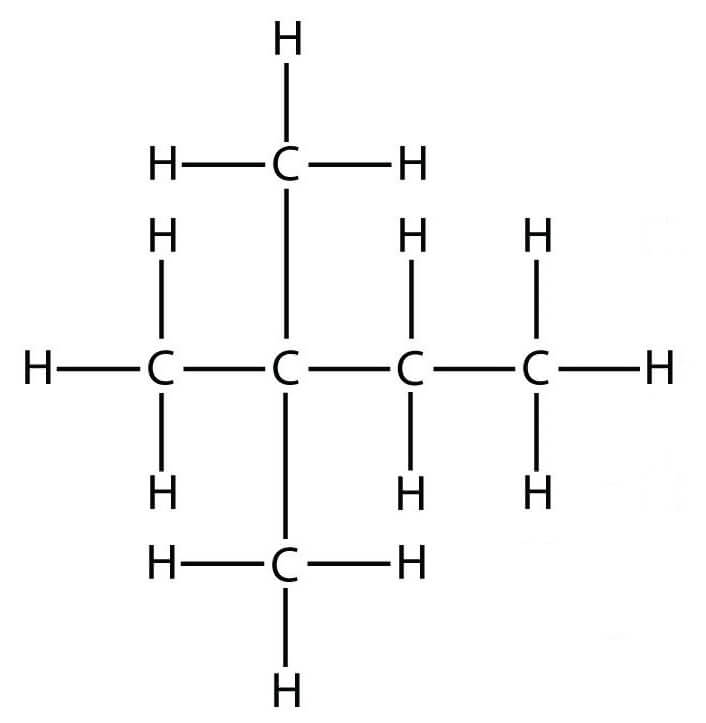 Все изомеры гексана представляют собой бесцветную жидкость со слабым запахом, напоминающую дихлорэтан.
Все изомеры гексана представляют собой бесцветную жидкость со слабым запахом, напоминающую дихлорэтан.В природе содержится в природном газе, добываемом с газовых и газоконденсатных месторождений нефти и газа, в нефти (в значительных количествах). Также содержится в сланцевом масле, сланцевом газе.
Легковоспламеняющиеся и взрывоопасные.
Слабо растворим в воде. Растворим в органических веществах (ацетон, бензол, хлороформ, диэтиловый эфир и др.).
Токсично. Гексан обладает сильным наркотическим действием. Четвертый класс опасности.
Физические свойства гексана
| Название параметра: | Значение: |
| Цвет | Без цвета |
| Запах | слабый запах, напоминающий дихлорэтан |
| Агрегатное состояние (при 20 ° С и атмосферном давлении 1 атм.) | жидкость |
| Плотность н-гексана (при 20 ° С и атмосферном давлении 1 атм.) Кг / м3. | 654,8 |
| Плотность н-гексана (при 0 ° С и атмосферном давлении 1 атм.) Кг / м3. | 677,4 |
| Температура плавления н-гексана, ° С | -95,3 |
| Температура плавления 2-метилпентана (изогексана), ° C | -153,7 |
| Температура плавления 3-метилпентана, ° С | -118 |
| Температура плавления 2,3 они (диизопропил), ° С | -128,5 |
| Температура плавления 2,2 они (неогексан), ° С. | -99,9 |
| Температура кипения н-гексана, ° С | 68,7 |
| Температура кипения 2-метилпентана (изогексана), ° C | 60,3 |
| Температура кипения 3-метилпентана, ° С | 63,3 |
| Температура кипения 2,3 они (диизопропил), ° C | 58 |
| Температура кипения 2,2 они (неогексан), ° С | 49,73 |
| Температура воспламенения н-гексана, ° С | 233 |
| Температура вспышки н-гексана, ° С | -23 |
| Критическая температура н-гексана, ° С | 234,7 |
| Критическое давление н-гексана, МПа | 3,032 |
| Взрывоопасная концентрация газовой смеси н-гексан с воздухом,% по объему | from of 1.24 to 7.5 |
| Удельная теплота сгорания н-гексана, МДж / кг | 45,105 |
| Молярная масса, г / моль | 86,17848 |
Химические свойства гексана
Химические свойства гексана аналогичны свойствам других представителей ряда алканов. Значит, для него характерна такая же химическая реакция.
Применение и использование гексана
- входит в состав бензина
- при отжиме растительных масел
- составные клеи,
- как органический растворитель,
- как сырье для производства бензола.
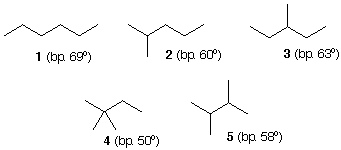
|
Пять структурных изомеров гексанов показаны в структурах 1-5. Структура 1 может быть перегруппирована с образованием четырех других конституционных изомеров. Если вы воспользуетесь воображаемой парой «химических ножниц», чтобы отрезать метильную группу от цепи, у вас останутся фрагменты C1 и C5. Вы можете повторно присоединить остаток C1 к C2 (так же, как C4) остатка C5, чтобы сформировать изомер 2, или добавить остаток C1 к C3 фрагмента C5, чтобы получить изомер 3. Остальные изомеры 4 и 5 могут быть образованы из две единицы C1 и фрагмент C4 с прямой цепью. Все пять структурных изомеров гексана имеют одинаковую молекулярную формулу C6H14 и одинаковую молекулярную массу 86. Однако каждый из гексанов имеет уникальную температуру кипения.
Если мы снова воспользуемся нашими «химическими ножницами», чтобы разрезать уникальную связь CH в н-гексане, структура 1, и вставить двухвалентный кислород в точку разрыва, мы получим три конституционально изомерных гексанола: 1-гексанол (6) , 2-гексанол (7) и 3-гексанол (8). Используя ту же технику для разрезания уникальных связей CC в н-гексане (1) с последующим введением кислорода, образуются три простых эфира: метил-н-пентиловый эфир (9), н-бутилэтиловый эфир (10) и ди-н-пропиловый эфир. (11). Каждое из шести соединений имеет молекулярную формулу C6H14O, одинаковую молекулярную массу 102, но разные точки кипения. Обратите внимание, что точки кипения спиртов всегда выше, чем точки кипения простых эфиров, хотя все они имеют одинаковую массу. Более высокая температура кипения спиртов обусловлена их способностью образовывать водородные связи, как и вода, имеющая очень высокую температуру кипения для своей массы. Аналогичное упражнение можно было бы проделать с гексанами 2-5, чтобы получить новую серию спиртов и эфиров.
Стереоизомеры Гексана:
Стереоизомеры Гексана - это изомеры, которые имеют одинаковую связность атомов, но различаются только их ориентацией в пространстве. Стереоизомеры включают геометрические изомеры, диастереомеры и энантиомеры. Наиболее распространенное определение этих трех классов начинается с энантиомеров. Энантиомеры - это стереоизомеры, которые не могут быть перекрыты зеркальными отображениями друг друга. Диастереомеры традиционно определяют как стереоизомеры, которые не являются зеркальным отображением друг друга. Геометрические изомеры (цис-транс) представляют собой стереоизомеры по двойной связи. Вместо того, чтобы сначала обсуждать более сложные стереоизомеры - поскольку мы действительно продвигались от более сложных изомеров к менее сложным - мы сначала рассмотрим энантиомеры в следующем разделе, а затем перейдем к другим стереоизомерам - диастереомерам. и геометрические изомеры.
В большинстве учебников используются эти определения, хотя различие между диастереомерами и геометрическими изомерами возникает из-за того, что определение подразумевает, что диастереомер является хиральным, а геометрический изомер - ахиральным. Более простой подход состоит в том, чтобы заявить, что любая пара стереоизомеров, которые не являются энантиомерами, являются диастереомерами. Такое определение диастереомера снимает проблему хиральности из определения.
Энантиомеры Гексана:
Энантиомеры Гексана - это просто пара стереоизомеров, которые не могут накладываться друг на друга в зеркальном отображении. Чтобы быть энантиомером, вещество должно быть хиральным (хиральным), то есть не иметь плоскостей симметрии или центра симметрии. Энантиомеры бывают только парами, и они не могут накладываться друг на друга. Рука - наиболее распространенная хиральная сущность. Ваша левая рука отражает вашу правую руку, и они не накладываются друг на друга. Многие обычные объекты являются хиральными: винты, винтовые лестницы, перчатки, обувь, большинство узлов и т. Д. Чтобы объект был ахиральным, он должен иметь как минимум одну плоскость симметрии. Вот некоторые примеры: человеческое (внешнее) тело в первом приближении (двусторонняя симметрия), кофейная кружка, очки для чтения и т. Д.
Энантиомеры чаще всего образуются, когда атом углерода (sp3-гибридизованный) содержит четыре различных заместителя. Есть два способа присоединить заместители к четырехвалентному углероду. Эти две компоновки являются энантиомерами друг друга. Атом углерода в таких разновидностях часто называют хиральным, но это неправильное название. Хиральным является не атом углерода, а среда вокруг атома углерода. Как мы видели, свойство хиральности не зависит от химии и, в этом отношении, атомов. В энантиомерах 12 и 13, показанных ниже (Как манипулировать структурами JSmol), представьте, что черный «шар» полностью невидим на черном фоне. Четыре цветных шара образуют хиральную среду, независимую от черного шара и «палочек», которые удерживают четыре цветных шара на расстоянии друг от друга.
Диастереомеры Гексана:
Еще один поворот затменной конформации 20b на 60o в том же направлении дает энантиомер (зеркальное отображение) 20a, а именно ent-20a. Это еще один пример стохастической хиральности, который встречался выше при обсуждении н-бутана. Ахиральная структура 20 называется мезосоединением. Его нельзя разделить на энантиомеры, потому что он ахиральный и его зеркальное отображение обязательно накладывается само на себя. С другой стороны, диастереомер 20, а именно 21, является хиральным. Ни в шахматной конформации 21а, ни в затмеваемой конформации 21b, ни в любой другой конформации, которую вы хотите создать, нет зеркальной плоскости.
Диастереомер 21 является хиральным независимо от того, насколько сильно вращается связь. Это означает, что 21 является диастереомером 20, а структура 21 должна иметь энантиомер ent-21. Диастереомер 21 и его энантиомер образуют рацемат, называемый d, l-парой. Каждый энантиомер d, l-пары является хиральным, и рацемат в принципе способен разделяться на свои энантиомеры.
Теперь представьте преобразование одного из красных атомов в 20 и 21 в фиолетовый, как показано на 22 и 23 соответственно. Тем самым была исключена возможность образования мезо-изомера. Любая одна структура является диастереомером двух других и энантиомером одной. Убедитесь в наличии этих диастереомерных и энантиомерных отношений, манипулируя структурами.
Геометрические изомеры Гексана:
Геометрические изомеры Гексана (E / Z-изомеры) представляют собой стереоизомеры с двойными связями. Они ахиральны. (E) -2-бутен (слева внизу) и (Z) -2-бутен (справа внизу) оба являются ахиральными, и оба изомера накладываются на их зеркальные соответствующие зеркальные изображения. Каждый из них представляет собой отдельные алкены с уникальными свойствами, и они (легко) не превращаются друг в друга. Вращение вокруг сильной двойной связи (серые атомы) запрещено.
Токсичность Изомеров Гексана
Острая токсичность изомеров Гексана относительно невысока, хотя он является слабым анестетиком. Вдыхание высоких концентраций вызывает сначала состояние легкой эйфории, за которым следует сонливость с головными болями и тошнотой. Хроническая интоксикация гексаном наблюдалась у лиц, злоупотребляющих растворителями в рекреационных целях, а также у рабочих в производстве обуви, реставрации мебели и автомобилестроении. Первоначальные симптомы - покалывание и судороги в руках и ногах, за которыми следует общая мышечная слабость. В тяжелых случаях наблюдается атрофия скелетных мышц, потеря координации и проблемы со зрением.
Нейропатическая токсичность н-гексана для людей хорошо известна; Случаи полинейропатии обычно наблюдались у людей, хронически подвергавшихся воздействию н-гексана в диапазоне от 400 до 600 частей на миллион, а время от времени - до 2500 частей на миллион. Необычная токсичность н-гексана (по сравнению с другими алканами) привела к тому, что химическая промышленность по возможности отказалась от н-гексана в пользу н-гептана. Подобные симптомы наблюдаются на животных моделях. Они связаны с дегенерацией периферической нервной системы (и, в конечном итоге, центральной нервной системы), начиная с дистальных частей более длинных и широких нервных аксонов. Токсичность возникает не из-за самого гексана, а из-за одного из его метаболитов, гексан-2,5-диона.
Считается, что это реагирует с аминогруппой боковой цепи остатков лизина в белках, вызывая перекрестное сшивание и потерю функции белка. Последствия отравления гексаном у людей неизвестны. В 1994 году н-гексан был включен в список химических веществ в Перечне токсичных выбросов. Во второй половине 20-го и начале 21-го веков ряд взрывов связывали с горением газообразного гексана. В 2001 году Агентство по охране окружающей среды США издало правила по контролю за выбросами гексана из-за его потенциальных канцерогенных свойств и экологических проблем.
